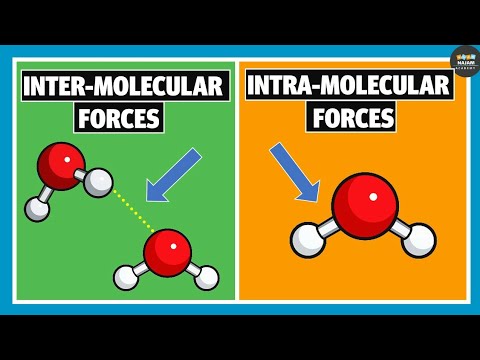
تفاوت کلیدی - پیوند بین مولکولی در مقابل پیوند هیدروژنی درون مولکولی
پیوند هیدروژنی شکلی از نیروی جاذبه بین مولکول های قطبی خاص است. این یک نوع پیوند ضعیف نسبت به پیوندهای یونی یا کووالانسی است، اما در مقایسه با نیروهای دوقطبی-دوقطبی و نیروهای واندروال، نیروهای جاذبه قوی هستند. پیوند هیدروژنی تشکیل می شود اگر مولکول قطبی دارای یک اتم به شدت الکترونگاتیو با یک جفت الکترون تنها (که می تواند به عنوان دهنده الکترون عمل کند) به یک اتم هیدروژن (یک گیرنده الکترون) پیوند داشته باشد. از آنجایی که اتم به شدت الکترونگاتیو می تواند نسبت به اتم هیدروژن، الکترون همتراز پیوند را به سمت خود جذب کند، اتم هیدروژن یک بار مثبت جزئی دریافت می کند که منجر به جدایی بار قوی می شود.از این رو، پیوندهای شیمیایی رایج تشکیل دهنده پیوند هیدروژنی، پیوند O-H، پیوند N-H و پیوند F-H است. دو شکل از پیوندهای هیدروژنی وجود دارد که می توانند تشکیل شوند. پیوند هیدروژنی بین مولکولی که بین مولکول های قطبی ایجاد می شود و پیوند هیدروژنی درون مولکولی که در یک مولکول واحد رخ می دهد. تفاوت اصلی بین پیوند هیدروژنی بین مولکولی و درون مولکولی در این است که پیوند هیدروژنی بین مولکولی بین دو مولکول رخ می دهد در حالی که پیوند هیدروژنی درون مولکولی در یک مولکول منفرد رخ می دهد.
پیوند هیدروژنی بین مولکولی چیست؟
پیوندهای هیدروژنی بین مولکولی بین مولکول های جداگانه در یک ماده ایجاد می شود. بنابراین، الکترون دهنده و گیرنده الکترون باید در دو مولکول جداگانه وجود داشته باشند. اگر اهداکننده و گیرنده الکترون مناسب وجود داشته باشد، هر مولکولی میتواند پیوندهای هیدروژنی تشکیل دهد.

شکل 01: پیوند هیدروژنی بین مولکولی در مولکول های آب
یک مثال معمول برای مولکول هایی که می توانند پیوندهای هیدروژنی بین مولکولی ایجاد کنند، مولکول های آب هستند (H2O). پیوندهای هیدروژنی بین مولکول های آب باعث تشکیل یک ساختار صلب می شود. وقتی آب مایع به یخ جامد تبدیل می شود.
پیوند هیدروژنی درون مولکولی چیست؟
پیوندهای هیدروژنی درون مولکولی پیوندهایی هستند که در یک مولکول منفرد ایجاد می شوند. این نوع پیوند هیدروژنی زمانی ایجاد می شود که دو گروه عاملی که قادر به تشکیل پیوند هیدروژنی با یکدیگر هستند در یک مولکول واحد وجود داشته باشند. این بدان معناست که هم دهنده الکترون و هم گیرنده الکترون باید در یک مولکول وجود داشته باشند.

شکل 02: پیوند هیدروژنی درون مولکولی در سالیسیل آلدئید
علاوه بر این، این دو گروه عاملی باید به اندازه کافی نزدیک به این پیوند هیدروژنی قرار گیرند. رایج ترین نمونه مولکولی که این نوع پیوند هیدروژنی را نشان می دهد سالیسیل آلدئید است (C7H6O2).
تفاوت بین پیوند هیدروژنی بین مولکولی و درون مولکولی چیست؟
پیوند بین مولکولی در مقابل هیدروژنی درون مولکولی |
|
| پیوندهای هیدروژنی بین مولکولی بین مولکول های جداگانه در یک ماده ایجاد می شود. | پیوندهای هیدروژنی درون مولکولی آنهایی هستند که در یک مولکول منفرد ایجاد می شوند. |
| اجزای | |
| پیوندهای هیدروژنی بین مولکولی بین دو مولکول تشکیل می شود. | پیوندهای هیدروژنی درون مولکولی بین مولکول های جداگانه تشکیل می شود. |
خلاصه - پیوند بین مولکولی در مقابل پیوند هیدروژنی درون مولکولی
پیوند هیدروژنی شکلی از برهمکنش دوقطبی-دوقطبی است. اما یک نوع پیوند ضعیف است. پیوند هیدروژنی به دو شکل پیوند هیدروژنی بین مولکولی و درون مولکولی وجود دارد. تفاوت بین پیوند هیدروژنی بین مولکولی و درون مولکولی در این است که پیوند هیدروژنی بین مولکولی بین دو مولکول اتفاق می افتد در حالی که پیوند هیدروژنی درون مولکولی در یک مولکول واحد رخ می دهد.