تفاوت اصلی بین نمودار مداری و پیکربندی الکترون در این است که نمودار مداری الکترون ها را در فلش نشان می دهد که نشان دهنده اسپین الکترون ها است. اما، پیکربندی الکترون جزئیاتی را در مورد اسپین الکترون ها نشان نمی دهد.
نمودار مداری آرایش الکترون ها را نشان می دهد که توسط پیکربندی الکترون ارائه شده است. پیکربندی الکترون جزئیاتی را در مورد توزیع الکترون ها در سراسر اوربیتال های اتم می دهد. اما، نمودار مداری اسپین الکترون ها را نیز نشان می دهد. این تفاوت اساسی بین نمودار مداری و پیکربندی الکترون است.
نمودار مداری چیست؟
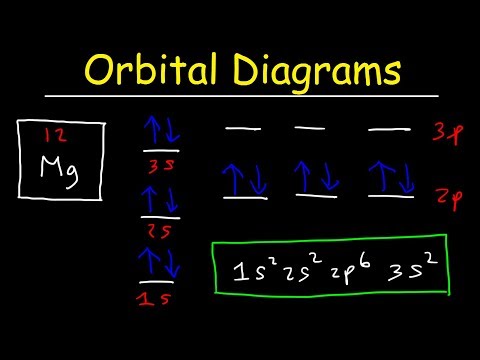
نمودار مداری نوعی نمودار است که توزیع الکترون ها را در اوربیتال های یک اتم نشان می دهد و اسپین آن الکترون ها را نشان می دهد. این یک نوع علامت گذاری است که نشان می دهد کدام اوربیتال پر شده و کدام یک تا حدی پر شده است. در اینجا، ما از فلش ها برای نشان دادن الکترون ها استفاده می کنیم. جهت نوک پیکان (به سمت بالا یا پایین) نشان دهنده اسپین الکترون است.

شکل 01: نمودار مداری برای نیتروژن
یک اوربیتال می تواند حداکثر دو الکترون داشته باشد. طبق اصل طرد پائولی، دو الکترون در یک اتم نمی توانند مجموعه عدد کوانتومی یکسانی داشته باشند. این بدان معناست که حتی اگر همه اعداد کوانتومی دیگر یکسان باشند، عدد کوانتومی اسپین متفاوت است.دو الکترون در یک اوربیتال دارای اسپین مخالف هستند. تصویر بالا نمونه ای از نمودار مداری را نشان می دهد.
پیکربندی الکترون چیست؟
پیکربندی الکترون روشی برای مرتب کردن الکترونهای یک اتم با نشان دادن توزیع آن الکترونها در سراسر اوربیتالها است. پیش از این، پیکربندی الکترون با استفاده از مدل بور اتم توسعه یافته بود. این برای اتمهای کوچک با الکترونهای کمتر دقیق است، اما وقتی اتمهای بزرگ را با تعداد زیادی الکترون در نظر میگیریم، باید از نظریه کوانتومی برای تعیین توزیع الکترون استفاده کنیم.
طبق مکانیک کوانتومی، پوسته الکترونی حالتی است که چندین الکترون از یک عدد کوانتومی اصلی مشترک هستند، و ما پوسته را با استفاده از عدد داده شده برای سطح انرژی و نوع اوربیتال مورد نظرمان نامگذاری می کنیم، به عنوان مثال، 2s به اوربیتال s لایه الکترونی سطح انرژی 2 اشاره دارد. علاوه بر این، الگویی وجود دارد که حداکثر تعداد الکترون هایی که یک پوسته الکترونی می تواند داشته باشد را توصیف می کند.در اینجا، این حداکثر عدد به عدد کوانتومی آزیموتال، l بستگی دارد. علاوه بر این، مقادیر l=0، 1، 2 و 3 به ترتیب به اوربیتال های s، p، d و f اشاره دارد. حداکثر تعداد الکترون هایی که یک پوسته می تواند داشته باشد=2 (2l+1). بنابراین، می توانیم جدول زیر را توسعه دهیم؛
| اوربیتال | حداکثر تعداد الکترون 2(2l+1) |
| L=0 اوربیتال است | 2 |
| L=1 اوربیتال p است | 6 |
| L=2 است d اوربیتال | 10 |
| L=3 f اوربیتال است | 14 |

هنگام در نظر گرفتن نماد پیکربندی الکترون، باید از دنباله اعداد کوانتومی استفاده کنیم. برای مثال، پیکربندی الکترون برای اتم هیدروژن 1s1 است در اینجا، این نماد می گوید که اتم های هیدروژن دارای یک الکترون در اوربیتال s اولین لایه الکترونی هستند. برای فسفر، پیکربندی الکترون 1s22s22p63s2 است. 3p3 به این معنی است. اتم فسفر دارای 3 لایه الکترونی پر از 15 الکترون است.
تفاوت بین نمودار مداری و پیکربندی الکترون چیست؟
نمودار مداری آرایش الکترون ها را نشان می دهد که توسط پیکربندی الکترون ارائه شده است. تفاوت اصلی بین نمودار مداری و پیکربندی الکترون در این است که نمودار مداری الکترون ها را در فلش هایی نشان می دهد که اسپین الکترون ها را نشان می دهد. در همین حال، پیکربندی الکترون جزئیاتی در مورد اسپین الکترون ها نشان نمی دهد. علاوه بر این، در الگوی نمادگذاری، نمودارهای مداری از فلشها برای نشان دادن الکترونها استفاده میکنند، در حالی که پیکربندی الکترون نشاندهنده الکترونها با استفاده از اعداد است.
در زیر خلاصه ای از تفاوت بین نمودار مداری و پیکربندی الکترون آمده است.

خلاصه - نمودار مداری در مقابل پیکربندی الکترون
تفاوت اصلی بین نمودار مداری و پیکربندی الکترون این است که نمودار مداری الکترونها را در فلشهایی نشان میدهد که اسپین الکترونها را نشان میدهند، در حالی که پیکربندی الکترون جزئیات اسپین الکترونها را نشان نمیدهد.